Poblacion de pacientes
Se inscribió un total de 55 pacientes en el estudio, incluidos 37 (67,3 %) pacientes con enfermedad sin progresión (no EP) y 18 (32,7 %) pacientes con EP. Los pacientes con DP experimentaron una supervivencia general (SG) más corta que los pacientes sin DP (9,35 meses versus no alcanzada, PAG< 0,001, figura 1a). La mediana de edad de los pacientes en el entorno general fue de 53,0 años (rango, 43,0–55,0) y la mayoría de los pacientes eran hombres (90,9 %). La etiología del CHC de la hepatitis B representó el 94,5 % y el 67,3 % de los pacientes tenían un nivel de alfafetoproteína > 200 ng/mL. Su puntuación media de albúmina-bilirrubina (ALBI) fue de -2,60, que fue relativamente más alta en pacientes con EP que en pacientes sin EP (-2,29 frente a -2,76, PAG< 0,001). La mediana de los niveles de plaquetas (PLT), aspartato transaminasa (AST), alanina transaminasa (ALT) y fosfatasa alcalina (ALP) fue de 194,00 x 109/L, 60,30 U/L, 44,50 U/L y 134,10 U/L, respectivamente. Al inicio del estudio, el 61,8 % y el 38,2 % de los pacientes tenían varios tumores y un solo nódulo, respectivamente. El diámetro del tumor fue > 5 cm en el 81,8% de los pacientes y < 5 cm en el 18,2%. Las proporciones de pacientes con invasión vascular macroscópica y diseminación extrahepática al inicio del estudio fueron 80% y 34,5%, respectivamente. No se informaron diferencias características para estas variables (PAG> 0,05) excepto ALBI (Tabla 1).
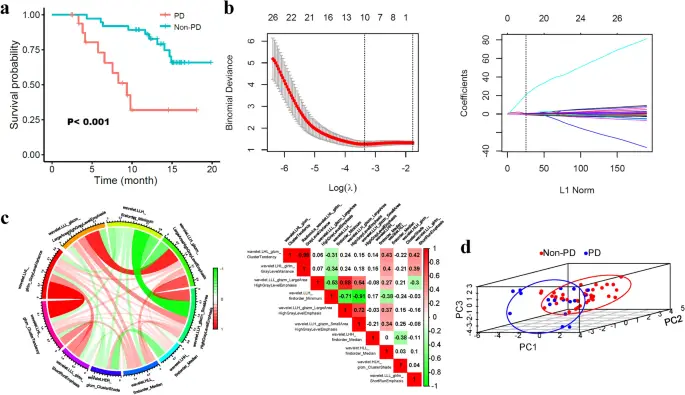
Características de la radiómica del proceso de selección para predecir la enfermedad progresiva (EP). (a) PD y no PD estratificaron la supervivencia global (SG) de los pacientes con CHC tratados con TKI-PD-1. (b) Método LASSO para encontrar las 10 características más significativas de la EP. (C) Un diagrama de cuerdas y un mapa de calor ilustran la matriz de correlación entre las 10 características. En el diagrama de cuerdas de la izquierda, cuanto más anchas son las bandas, más estrecha es la correlación. En el mapa de calor derecho (generado por el software R versión 3.6.0), las características emparejadas correlacionadas se exhiben con fondos de color. El rojo indica una correlación positiva; el verde indica una correlación negativa. (d) Análisis de componentes principales de las características correlacionadas con DP.
Selección y análisis de características radiómicas
En total, se adquirieron 2458 características para cada paciente, entre las cuales se excluyeron 568 características con coeficientes de correlación intraclase (ICC) < 0,90, dejando 1890 características para un análisis posterior. Luego, se identificaron 10 características discriminatorias relacionadas con wavelet entre los pacientes sin EP y con EP evaluados por RECIST 1.1 a través de la selección de características del operador de selección y contracción mínima absoluta (LASSO) (Fig. 1b, Tabla complementaria S1).
Después de obtener estas 10 características, exploramos más a fondo sus relaciones utilizando el análisis de correlación de Spearman. El diagrama de acordes muestra enlaces entre las características (que se muestran en la Fig. 1c). Obviamente, las bandas anchas de color rojo cálido indicaban que la característica 1 y la característica 2, la característica 3 y la característica 5, y la característica 5 y la característica 6 estaban significativamente relacionadas entre sí en la red. Mientras tanto, las funciones 4 y 6 se relacionaron negativamente con la conexión de banda ancha verde. En general, las relaciones detalladas entre las funciones se muestran en el mapa de calor de la figura 1c, y la función 1 y la función 2 tuvieron el coeficiente de correlación más alto (0,99) en el análisis de Spearman. A continuación, realizamos un proceso de análisis de componentes principales (PCA) para comprimir las características y reducir la dimensionalidad. Como se visualiza en la Fig. 1d, los pacientes con EP (grupo inferior izquierdo) podrían separarse de los pacientes sin EP (grupo superior derecho).
Los valores diferenciales se distribuyeron entre pacientes con PD y sin PD para todas las características radiómicas (Figura complementaria S1). Se observó una expresión más alta para las características 1, 2, 4, 7 y 10 en pacientes sin EP, y la diferencia para la característica 1 fue significativa (PAG<0,05). Por el contrario, los pacientes con EP mostraron una expresión relativamente alta de las características 3, 5, 6, 8 y 9, pero la diferencia no fue significativa (PAG> 0,05). El área bajo la curva característica operativa (AUC) del receptor para la predicción de PD osciló entre 0,572 y 0,664 para las diez características, como se muestra en la Figura complementaria S2. Entre estas características, el AUC de la característica 4 fue 0,661 (IC 95 %: 0,500–0,822) y el AUC de 6 fue 0,664 (IC 95 %: 0,509-0,818), las cuales alcanzaron significación en el análisis ROC (PAG<0,05).
Algoritmo de aprendizaje automático basado en radiómica predice la respuesta
Diez algoritmos distinguieron la EP de la enfermedad que no es EP con eficacia variada. En general, se observaron mejores resultados de predicción en la cohorte de entrenamiento que en la cohorte de prueba (Fig. 2). Los diez algoritmos, incluida la máquina de vectores de soporte (SVM), Naïve Bayes (NB), partición recursiva y árboles de regresión (Rpart), árboles de inferencia condicional (Ctree), bosques aleatorios (RF), k-vecinos más cercanos (KNN), neuralnet, impulso, embolsado y logística, obtuvieron puntuaciones F1 medias de 0,88, 0,80, 0,85, 0,80, 1,00, 0,89, 0,96, 1,00, 0,91 y 0,82 en la cohorte de formación y 0,80, 0,69, 0,70, 0,80, 0,79, 0,76, 0,75 , 0,77, 0,74 y 0,74 en la cohorte de prueba, respectivamente. En general, el modelo de clasificación que utiliza el algoritmo SVM logró la mejor puntuación F1. Además, el algoritmo SVM predijo la no EP y la EP con una exactitud, sensibilidad, especificidad y precisión medias del 81,8 %, 100,0 %, 43,7 % y 78,8 %, respectivamente, en la cohorte de entrenamiento y del 69,1 %, 95,0 %, 20,0 % , y 70.6%, respectivamente, en la cohorte de prueba (Tabla complementaria S2).

El diagrama de caja muestra la puntuación F1, la exactitud, la sensibilidad, la especificidad y la precisión de diez modelos de aprendizaje automático en las cohortes de entrenamiento y prueba.
Los valores de AUC de cada modelo fueron generalmente más altos en la cohorte de entrenamiento que en la cohorte de prueba (Fig. 3). Se exhibieron diferentes precisiones de los modelos, entre las cuales el modelo SVM tuvo la puntuación AUC más alta de 0,933 en la cohorte de entrenamiento y 0,792 en la cohorte de prueba. Los algoritmos SVM, Bayes y embolsado lograron AUC > 0,7 en la cohorte de prueba.
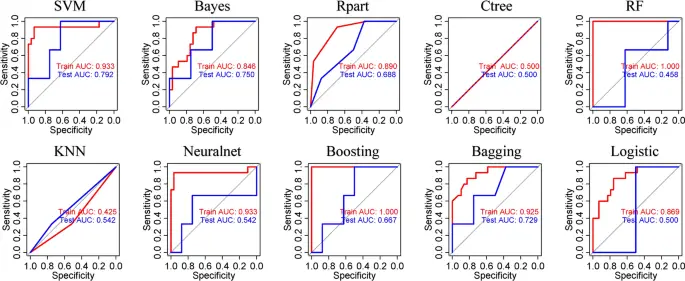
La precisión general de diez algoritmos de aprendizaje automático se evaluó por área bajo las curvas características operativas del receptor en las cohortes de entrenamiento y prueba.
Análisis de supervivencia
En total, 19 pacientes fallecieron durante el seguimiento. La OS no se alcanzó en todos los pacientes, y la OS en los subgrupos en función de los fármacos utilizados se presenta en la Figura complementaria S3, que no muestra diferencias significativas entre los subgrupos según los fármacos utilizados (PAG= 0,990). Se utilizó la prueba de rango logarítmico para comparar características radiómicas altas versus bajas con la supervivencia. Se encontró que cuatro de cada diez funciones estaban significativamente asociadas con el sistema operativo, incluida la función 4 (PAG= 0.039), función 5 (PAG= 0.049), característica 8 (PAG= 0.018), y característica 9 (PAG= 0.041), como se muestra en la Figura complementaria S4. Se realizó un análisis de regresión de Cox que incorporó características radiómicas y variables clínicas para identificar los factores asociados con la supervivencia (Fig. 4a). Un total de 7 factores (características 4, 6, 8, ALBI, diámetro del tumor, ALT e invasión de la vena porta) generados en el modelo de regresión de Cox univariante se seleccionaron adicionalmente para incluirlos en el modelo de regresión de Cox multivariante. Finalmente, la función 4 (PAG= 0,002) y característica 6 (PAG= 0,001) fueron factores de supervivencia favorables, mientras que la característica 8 (PAG= 0,033), ALBI (PAG= 0,032) e invasión de la vena porta (PAG= 0,002) fueron factores de supervivencia peligrosos en el modelo de regresión multivariable de Cox con un índice c de 0,81 (Fig. 4b). La Figura 4c muestra el mayor beneficio neto de usar un modelo que comprende características clínicas más radiómica que usar un modelo clínico.
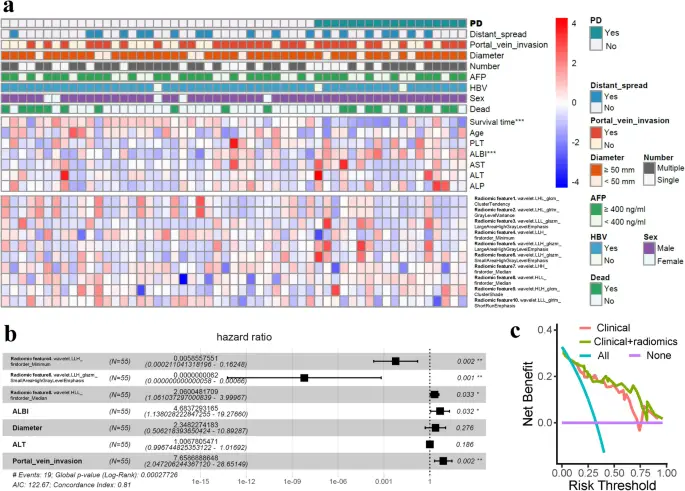
El panorama de los rasgos radiómicos y las características clínicas. (a) Los pacientes con enfermedad progresiva (EP) tuvieron tiempos de supervivencia más cortos y puntajes de albúmina-bilirrubina (ALBI) más altos; sus características radiómicas exhibieron niveles de expresión diferenciales entre pacientes con PD y sin PD. (b) Las características radiómicas 4, 6 y 8, ALBI y la invasión de la vena porta fueron factores asociados con la supervivencia en el análisis de supervivencia de regresión de Cox univariable y multivariable. (C) Beneficio neto adicional de la radiómica en el análisis de la curva de decisión. ***PAG< 0,001; **PAG<0,01; *PAG<0,05.

